Un cœur artificiel pour révolutionner la chirurgie cardiaque

Un chirurgien cardiaque qui invente un ingénieux système de prothèse de cœur. Une équipe de scientifiques toulousains à la pointe de la biomécanique des fluides. Une collaboration originale initiée en 1977 et qui va durer huit ans. Une période où la chirurgie du cœur fait des pas de géant. Voici l’histoire du prototype CORA, un cœur artificiel passé à deux doigts de révolutionner la prise en charge des personnes atteintes de maladies cardiaques.
« Le sang est un liquide complexe dont le comportement mécanique n’obéit pas aux mêmes lois que l’eau ou l’air. L’étudier dans le cadre d’un projet de cœur artificiel nécessite des compétences propres aux chercheurs spécialisés en biomécanique des fluides. »
Didier Bellet est spécialisé en biorhéologie, l’étude des comportements et des écoulements de fluides biologiques. Il a travaillé plusieurs années avec son équipe de l’Institut de mécanique des fluides de Toulouse (IMFT) sur le cœur CORA, un prototype de cœur artificiel mécanique externalisé (non implantable) imaginé par un chirurgien marseillais Jean-Raoul Montiès. Au cœur du projet CORA, deux disciplines - science de l’ingénieur·e et science du vivant - ont collaboré pour comprendre le fonctionnement du cœur humain.
« Quand nous avons commencé à travailler sur ce prototype, en 1977, le domaine de la chirurgie cardiaque était en pleine ébullition », explique Didier Bellet. Dix ans auparavant, en décembre 1967, le chirurgien sud-africain Christiaan Barnard a, pour la première fois, réussi à greffer un cœur humain à un patient souffrant d’insuffisance cardiaque grave. L’opération est un échec ; le patient décède suite à l’incompatibilité biologique entre le « donneur » et le « receveur ». En avril 1968, c’est au tour d’une équipe de chirurgiens français dirigée par le Professeur Christian Cabrol. En novembre 1968, une équipe de chirurgiens marseillais, dont fait partie le docteur Jean-Raoul Montiès – le futur inventeur du cœur CORA – parvient à greffer Emmanuel Vitria, un des premiers patients qui survivra plusieurs années avec un cœur greffé.
Contourner le problème du rejet de greffe
« Malgré des performances impressionnantes, ces médecins se heurtaient tous à un obstacle majeur : le rejet de la greffe », raconte Didier Bellet. En raison d’un manque de compatibilité entre donneur et receveur, la plupart des patients ne survivent en effet au plus que quelques mois après l’opération. « Le cas d’Emmanuel Vitria est particulier ; s’il est parvenu à vivre 18 ans avec un cœur greffé, c’est en raison d’une compatibilité exceptionnelle avec son donneur. Cette survie s’explique aussi par l’utilisation d’un traitement antirejet inédit à l’époque et d’une surveillance et de précautions draconiennes pour diminuer les risques d’infection. »
Dans les années 1970, un certain nombre de médecins commencent à se demander si un cœur artificiel constitué de matériaux biologiquement inertes pourrait permettre de contourner ces problèmes de biocompatibilité et donc de rejet.
Cœur artificiel : des obstacles techniques majeurs
À cette époque, quelques expérimentations avec des cœurs artificiels ont bien été menées sur des animaux, comme le « cœur Jarvick » aux États-Unis (du nom de Robert Koffler Jarvik, chercheur connu pour son rôle dans le développement du cœur artificiel). Mais les résultats ne sont pas satisfaisants. Les appareils sont volumineux et bruyants ; leurs dispositifs très lourds (250 kilos !) et encombrants, cela est dû au compresseur relié au cœur artificiel. À l’image des dispositifs de dialyses qui remplacent le fonctionnement de reins défaillants. En plus, « ces cœurs nécessitaient des valves ayant tendance à s’encrasser et à générer des caillots ; ceci impliquait de réopérer tous les 8 à 10 ans des patients déjà âgés ou affaiblis par leur problèmes cardiaques », précise Didier Bellet.
Médecins et scientifiques du monde entier commencent donc à initier de nouvelles recherches. En France, où se trouve l’avant-garde de la chirurgie cardiaque, deux professeurs reconnus, Alain Carpentier et Jean-Raoul Montiès, conçoivent et expérimentent deux modèles différents de prothèses cardiaques. Alors qu’Alain Carpentier projette un cœur implantable souple et avec des valves, Jean-Raoul Montiès a l’idée d’un système de pompe rigide et sans valves, basé sur le principe du moteur Wankel. Ce moteur à piston rotatif, inventé dans les années 1950 par l’ingénieur allemand Felix Wankel, comporte trois chambres étanches : admission, compression/explosion et échappement. Il ferait alors circuler, non plus du carburant, mais du sang !
Le cœur CORA : un système imitant un cœur biologique
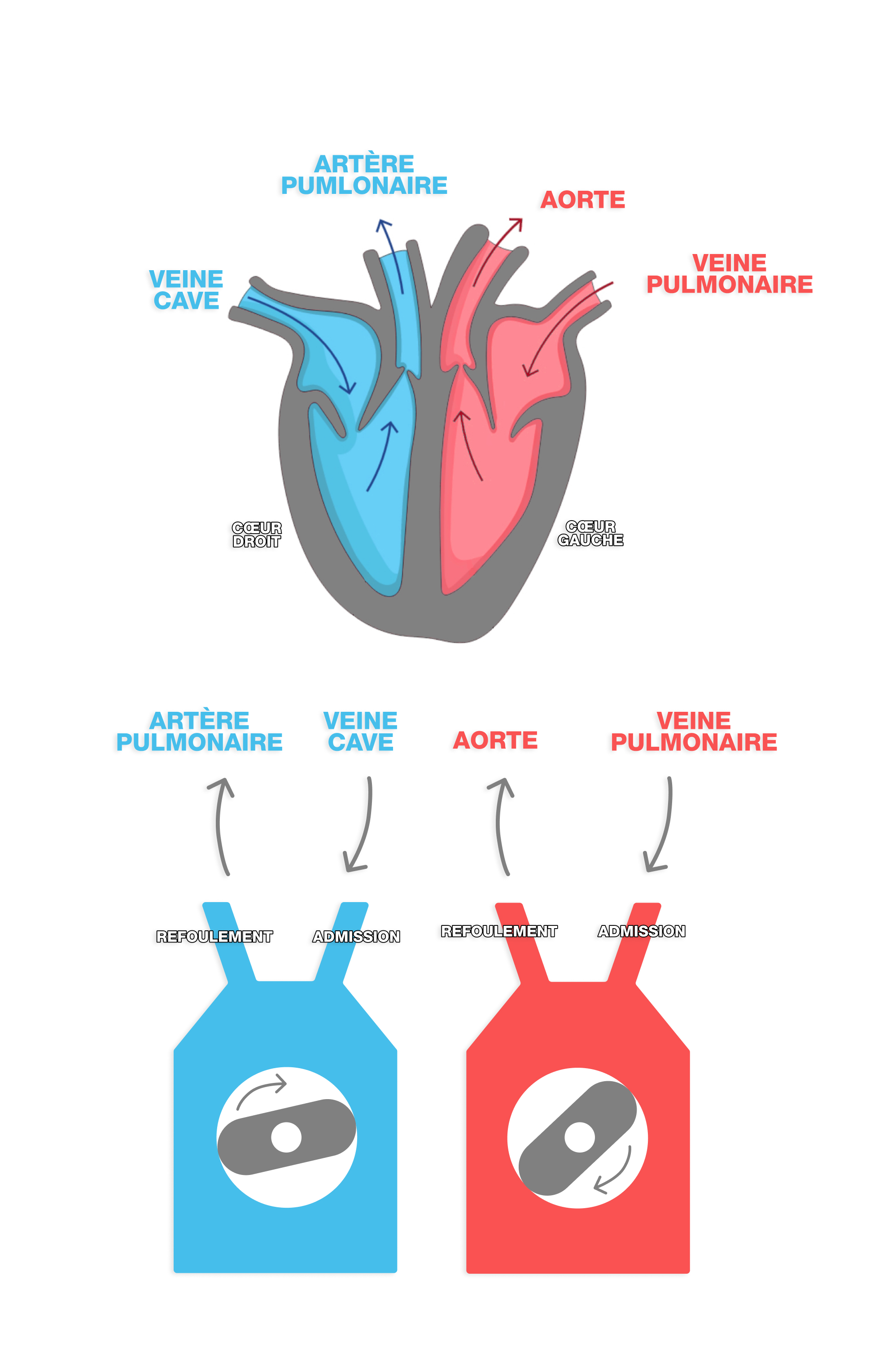
Jean-Raoul Montiès va modifier le moteur Wankel afin qu’il ne comporte que deux chambres et garde le principe des orifices d’admission et de refoulement (ou évacuation). La pompe est ainsi constituée d’un cylindre mobile, appelé « rotor », relié à un mini-moteur inclus qu’il est possible de piloter à distance, et d’une cavité cylindrique fixe, dite « stator », dans lequel tourne le rotor. Il le nomme CORA, pour COeur ARtificiel.
Son fonctionnement est simple : le sang pénètre par l’orifice d’admission, il est mis en mouvement par le rotor qui le pousse vers l’orifice de refoulement, donnant à son écoulement un caractère pulsatoire semblable à celui d’un cœur biologique.
L’idée du médecin est d’utiliser deux pompes quasi-identiques :
- une pompe pour le sang « bleu » pauvre en oxygène, correspondant à la partie droite du cœur biologique
- une pompe pour le sang « rouge » riche en oxygène, correspondant au cœur gauche

Les orifices d’admission et d’échappement de chacune de ces deux pompes sont destinés à être reliés aux vaisseaux du cœur : veine cave et artère pulmonaire pour le sang « bleu », veines pulmonaires et aorte pour le sang réoxygéné rouge. L’objectif, in fine, est de miniaturiser ces pompes pour en faire une prothèse cardiaque implantable en titane, matériau inerte et relativement léger.
🔎 Le sang, un fluide complexe à étudier 🫀
Didier Bellet a soutenu sa thèse de Doctorat ès Sciences sur des fluides caloporteurs (transporteurs de chaleur) utilisés dans des centrales nucléaires. Particularité de ces fluides : ils sont constitués d’eau chargée de particules de graphite (un minéral), ce qui leur confère un comportement mécanique « anormal », différent des fluides comme l’eau ou l’air. « Lorsqu'on exerce une pression croissante sur ces liquides, leur vitesse de déformation ne varie pas linéairement, contrairement au cas des liquides comme l'eau. Pour cette raison, on les qualifie de « non-newtoniens » (#IsaacNewton), explique le chercheur.
Le sang, parce qu’il est constitué de plasma dans lequel baignent des cellules (globules rouges, globules blancs et plaquettes), est lui aussi un fluide non-newtonien : il a des propriétés mécaniques spécifiques. Selon le contenant dans lequel il se trouve – une artériole de très petit diamètre ou une artère de gros calibre –, selon le degré d’élasticité de la paroi du vaisseau où il circule, selon la présence ou non d’obstacles à sa circulation (caillot, rétrécissement d’un vaisseau lié à l’accumulation de graisse...), le sang va avoir un comportement différent. C’est un fluide très complexe à étudier. »
Des ingénieur·es pour optimiser le système
Le docteur Montiès fait construire un prototype de la pompe à Marseille et, pour affiner son fonctionnement, le confie à l’équipe de chercheurs de l’IMFT dirigée par Didier Bellet et Dang Phuoc Ly, chercheur CNRS (centre national de la recherche scientifique). Les scientifiques de cette équipe ont pour mission d’étudier le comportement du sang dans le prototype CORA. L’objectif consiste à optimiser ses performances.
L’équipe de l’IMFT a acquis son expertise dans le domaine de l’hémodynamique (de « hémo », sang et « dynamique », mouvement dû à des forces d’entrainement) en collaborant avec des médecins et des chirurgien·nes cardio-vasculaires du CHU (centre hospitalier universitaire) de Rangueil à Toulouse.
L’équipe de biorhéologie va étudier les répartitions de vitesses et de pressions du sang traversant la prothèse CORA, afin que la pompe réponde aux impératifs physiologiques d’un·e futur·e receveur·se. Ils vont notamment travailler à améliorer la forme, les dimensions et les orientations des orifices d’admission et de refoulement.
Pour cela, les scientifiques utilisent un prototype en plexiglas transparent dans lequel circule une solution de viscosité semblable à celle du sang et contenant de fines particules (comme les cellules sanguines). À l’aide d’un vélocimètre à laser (appareil de mesure optique fonctionnant sur le même principe que les « radars » de la gendarmerie), ils vont analyser très finement les lignes de courants se formant dans la pompe, ainsi que l’évolution des vitesses des particules. Ceci va leur permettre d’effectuer des réglages de positionnement et d’inclinaison des orifices d’admission et d’évacuation, afin que les pressions et les lignes de circulation soient parfaitement adaptées aux besoins physiologiques d’un organisme humain.

🔎 CORA : des atouts non négligeables ❤️
Un volume réduit ;
Peu de bruit ;
Pas de valves (qui tendent à s’encrasser et à générer des caillots) ;
Dispositif léger facilement transportable (un simple fil électrique relié à une batterie commande la rotation du rotor) ;
Des pressions correctes et des lignes de courant régulières dans la pompe ;
Une alimentation motrice efficace et modulable en fonction des efforts physiques des patient·es.
Des résultats en demi-teinte
Les scientifiques parviennent à optimiser la pompe et à l’équiper d’une alimentation motrice capable de s’adapter aux efforts physiques de chaque patient·e. Ils la testent sur une chèvre qu’ils parviennent à faire vivre un mois. Tout fonctionne parfaitement, mais « le prototype avait un gros défaut : il fonctionnait comme un « presse-purée » avec les globules rouges, se souvient Didier Bellet. Ces cellules du sang se retrouvaient coincées entre la paroi du stator et le rotor, ce qui provoquait une hémolyse (destruction des globules rouges). Cela nécessitait de transfuser régulièrement les porteur·es. C’était un véritable problème. »
« Il faut être très humble. L’idée était géniale, mais la mise en œuvre compliquée. »
En 1985, huit ans après, faute de financement et de scientifiques disponibles pour prendre la relève, les travaux doivent malheureusement s’arrêter. « Il faut être très humble. L’idée était géniale, mais la mise en œuvre compliquée, à cause de cette dégradation du sang, explique Didier Bellet. Si on avait eu les financements qu’a connu le cœur CARMAT d’Alain Carpentier, qui est aujourd’hui un cœur artificiel performant et employé couramment pour prolonger la vie des patients, on aurait certainement pu effectuer des aménagements pour améliorer le prototype CORA. Ce projet innovant et humaniste mériterait d’être réactivé pour satisfaire à des progrès chirurgicaux performants. »
Quoi qu’il en soit, l’exemple de CORA montre combien la conjonction de travaux et de connaissances interdisciplinaires, ici entre sciences de l’ingénieur·e et sciences du vivant, peut bénéficier aux progrès scientifiques appliqués au domaine médical des prothèses chirurgicales.
Didier Bellet est Professeur émérite des universités en biomécanique des fluides spécialisé en biorhéologie, à Toulouse INP (Institut national polytechnique de Toulouse), ex-chercheur au sein de l’IMFT - Institut de mécanique des fluides de Toulouse (Toulouse INP, CNRS, Université Toulouse III - Paul Sabatier).
Aller plus loin :
Une histoire de cœur, Julie Pelletanne et Didier Bellet, UT-PATSTEC, 2022
Publication scientifique :
« Distributions de vitesses et de contraintes au sein du cœur artificiel HypoCycloidal sans clapet », Journal de Biophysique et Biomécanique, D. Bellet et M. Sengelin, 1985
Les dossiers Exploreur explorent un sujet en croisant le regard de plusieurs disciplines scientifiques. Journaliste : Véronique Molénat. Visuel : Delphie Guillaumé. Coordination et suivi éditorial : Catherine Thèves, Clara Mauler, Sandrine Tomezak, Julie Pelletanne, Christine Ferran, Manon Mesones, Simon Leveque, Valentin Euvrard.



